|
この間、ジャ○ネットを見ていたら、
「ちょっと科学的な話をさせてください。マイナスイオン濃度が・・・・」と言っていました。
科学的な話なのに、ナイナスイオンってどういう事さ?!
と言うことで、今回は、教科書に書いてあるイオンの話とマイナスイオンについて。
イオンと言っても、スーパーのことではありません。
スーパーのイオンは、AEONと書きますが、今からお話しするのは、ionと書きます。
ですから、語源すら違います。
教科書に書いてあるイオン
今の教科書では、中学校3年生で、イオンの勉強を初めてします。
流れとしては、1年生で、物質は粒子であることを勉強し、
2年生で、その粒子は、原子というさらに小さい粒子の集まりであることを勉強します。
そして、その原子を踏まえて、3年生で、イオンについて勉強します。
全ての物質は、100種類以上の原子でできていて、その組み合わせで、物質の種類が決まります。
原子については、コチラをご覧ください。
この原子が電気を帯びたものをイオンと呼んでいます。
目に見えない粒子が電気を帯びていることを確かめる実験は簡単で、
塩化銅水溶液を電気分解すれば、一発です。
塩化銅は、銅と塩素の化合物で、CuCl2と表します。
.png)
塩化銅のモデル
塩化銅を水溶液にして電気分解を行うと、陰極に銅が、陽極に塩素が引き寄せられ、
銅と塩素に分解されます。
陰極に引き寄せられるのは+の電気、陽極に引き寄せられるのは−の電気を持っているからです。
したがって、銅の粒子は+に、塩素の粒子は−に帯電していることが理解できます。
この帯電した銅と塩素の粒子(原子)をイオンと呼んでいます。
どうして原子が電気を帯びるの?
原子や分子が電気を帯びたものをイオンと呼ぶわけですが、
なぜ、原子が電気を帯びるのでしょうか?
原子が原子核とその周りを回る電子でできていることは以前お話ししました。
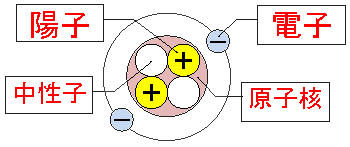 ヘリウム原子のモデル
ヘリウム原子のモデル
今回は、もう少し、細かく見ていきます。
原子核の中にある陽子の数により、原子の種類が決まり、
陽子と同じ数の電子がその周りをまわっています。
そして、電子が回るコースがある程度決まっています。
この回るコースを難しい言葉で、電子軌道と呼びます。
これを、モデルに表すと、次のようになります。
.png)
ナトリウム原子のモデル
このように電子が配置される訳ですが、これまた難しい言葉で、原子の電子配置と呼びます。
さて、このように、規則正しく電子を配置すると、ちょっと違和感がありますよね。
1番外の軌道にある電子が寂しそうですよね?
1人ぼっちで寂しそうな電子君が、何かを訴えてきますよね?
1人だけで寂しい電子君は、寂しさのあまり、いなくなってしまいます。
.png)
すると、0からマイナスが減るので、全体としては、+に傾いてしまいます。
こうやって、原子が電気を帯びます。
.png)
ナトリウムイオンの電子配置
.png)
当塾では、これをイオンのはみ子理論と呼んでいます。
これがイオンの正体です。
イオンは大きく2種類
さて、次の図は、塩素原子の電子配置です。
.png)
塩素原子のモデル
この図を見ていると、やはり、違和感を感じます。
一番外の軌道の電子君たちが、空席を埋めるために、もう1人電子君を呼び寄せます。
.png)
すると、0にマイナスを加えるので、全体としては、−に傾いてしまいます。
.png)
塩化物イオンの電子配置
.png)
このように、原子が+の電気を持ったり、−の電気を持ったりします。
+に帯電すると、陽イオン、−に帯電すると、陰イオンと呼びます。
イオンは、大きくこの2つに分類することができます。
+極のことを陽極、−極のことを陰極と言うので、覚えやすいですね。
さて、次の図は、マグネシウムの電子配置です。
.png)
マグネシウムのモデル
マグネシウムは、はみ子が2人います。
2人で仲良くしていれば良いのですが、マグネシウムの場合は、
2人で仲良く、いなくなります。
.png)
そうすると、0からマイナスが2ついなくなるので、+2に帯電します。
これを2価の陽イオンと呼びます。
ところで、1つの軌道に回ることができる電子の数は決まっていて、
内側から、2個、8個、8個・・・となっています。
ちなみに、軌道にも名前がついていて、内側からK殻、L殻、M殻・・・と言います。
そのため、電子の数によって、空席の数や、はみ子の数が決まるため、
原子によって、+に帯電しやすい原子、−に帯電しやすい原子が決まっています。
例えば、下の周期表の緑の原子は、+1に、青の現は+2に、
赤の原子は−1に、黄の原子は−2に帯電しやすい傾向があります。
周期表
| H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
He |
| Li |
Be |
|
|
|
|
|
|
|
|
|
|
B |
O |
C |
N |
F |
Ne |
| Na |
Mg |
|
|
|
|
|
|
|
|
|
|
Al |
Si |
P |
S |
Cl |
Ar |
| K |
Ca |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
Ga |
Ge |
As |
Se |
Br |
Kr |
| Rb |
Sr |
Y |
Zf |
Nb |
Mo |
Tc |
Ru |
Rn |
Pd |
Ag |
Cd |
In |
Sn |
Sb |
Te |
I |
Xe |
| Cs |
Ba |
La |
Hf |
Ta |
W |
Re |
Os |
Ir |
Pt |
Au |
Hg |
Ti |
Pb |
Bi |
Po |
At |
Rn |
| Fr |
Ra |
Ac |
Rf |
Db |
Sg |
Bh |
Hs |
Mt |
Ds |
Rg |
Cn |
|
Fl |
|
Lv |
|
|
いなくなった電子はどこに行くの?
こんな話を聞くと、1つの疑問が出てきます。
すねて出て行った電子君は、どこに行くのだろう?
そして、空席を埋めるために電子を呼ぶときは、どこから呼ぶんだろう?
この疑問を解決するために、塩素とナトリウムの化合物の塩化ナトリウム(食塩)で考えてみます。
不思議なことに、塩化ナトリウムが、何らかの理由でナトリウムと塩素に分かれるとき、
ナトリウム原子から、塩素原子に電子が移動します。
.png)
.png)
.png)
.png)
このように、普通の分子が、イオンとなって2つに分かれます。
これを難しい言葉で、電離と呼びます。
ですから、陰イオンと陽イオンは、セットで同時できることになります。
では、このような現象は、いつ起こるのでしょうか?
加熱したときでしょうか?圧力をかけたときでしょうか?
いえいえ、それが、意外と簡単で、水に溶けたときなんです。
つまり、イオンができるときは、物質が水に溶けたときです。
ところで、電離するときに必ず原子で分かれるかというと、そうではなく、分子のイオンも存在します。
特に、陰イオンは、分子の形で存在することの方が多いので、覚えておいて損はないです。
結局マイナスイオンって?
最後に、結局、マイナスイオンってなんなのさ?という話です。
マイナスイオンというので、マイナスに帯電した陰イオンの英語訳のような気がします。
しかし、陰イオンの英語訳はanion(アニオン)です。ちなみに陽イオンのことは、英語でcation(カチオン)
マイナスイオンではありません。
科学的に、マイナスイオンに相当する粒子は現在確認されておらず、
疑似科学という見方が強いようです。
結局、CMやらテレビショッピングで言っているマイナスイオンがなんなのかはわかりません。
そもそも、原子がイオン化するのは、水に溶けたときであり、
イオン単体が、空気中に浮遊しているというのも、中高の教科書レベルでは考えられない話です。
それに、マイナスがあればプラスもあるはずなので、
マイナスイオンがあると、同時に、プラスイオンもその場にあるはずなんです。
でも、そのこには触れないですし・・・
マイナスイオンが健康に良いというのも、もしかしたら、眉唾物かもしれません。
こちらもチェック
|
